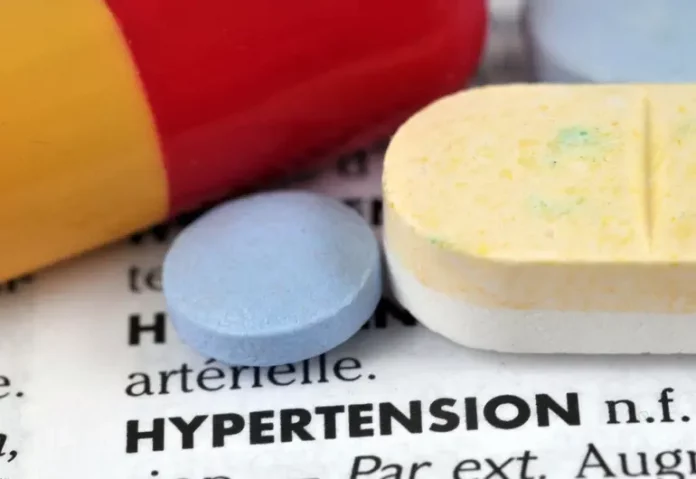
ESTADOS UNIDOS.- La FDA retira medicamento para la presión arterial por contaminante cancerígeno tras detectar niveles elevados de nitrosaminas, sustancias químicas asociadas a un mayor riesgo de cáncer. El retiro afecta miles de lotes del fármaco Prazosin Hydrochloride distribuidos en EE. UU.
La Food and Drug Administration (FDA) anunció la retirada de más de 580 000 botellas del fármaco Prazosin Hydrochloride tras detectar niveles de la impureza nitrosamina “N‑nitroso Prazosin Impurity C” que excedían los límites aceptados.
:quality(75)//media/inside-the-note/pictures/2025/10/31/la_fda-retira-medicamento-para-la-presio-arterial-por-contaminante-cancerigeno_3.jpg)
¿Qué se sabe del retiro del medicamento y por qué importa?
El fármaco Prazosin Hydrochloride, prescrito para tratar hipertensión arterial y algunas veces trastornos del sueño vinculados al estrés postraumático, estaba fabricado por Teva Pharmaceuticals USA. Según informes de la FDA, los lotes afectados contenían niveles de la nitrosamina mencionada que rebasaban los límites aceptables establecidos por el enfoque de Categoría de Potencia Carcinogénica (CPCA) de la agencia.
La clasificación del retiro fue “Clase II”, lo que significa que la exposición “puede causar efectos adversos temporales o médicamente reversibles, o donde la probabilidad de efectos graves es remota”.
Para los pacientes este anuncio implica un doble reto: seguir controlando su presión arterial y, al mismo tiempo, revisar su tratamiento ante la posibilidad de estar tomando un lote comprometido.
:quality(75)//media/inside-the-note/pictures/2025/10/31/la_fda-retira-medicamento-para-la-presio-arterial-por-contaminante-cancerigeno_1_0.jpg)
¿Cómo se descubrió la impureza y qué riesgos representa?
La detección de nitrosaminas
Las nitrosaminas son compuestos que pueden formarse durante la fabricación o almacenamiento de medicamentos y que están clasificados como posiblemente cancerígenos.
En el caso de Prazosin, la impureza N‑nitroso Prazosin Impurity C superó los límites de ingesta diaria aceptable establecidos por la FDA.
Evaluación del riesgo para el paciente
Aunque la agencia considera que el riesgo de cáncer por esta exposición es bajo, la presencia de una impureza incumple estándares de calidad farmacéutica. La FDA señala que no deben suspenderse los medicamentos sin consultar al médico, porque el riesgo de detener el tratamiento para la presión puede ser mayor.
¿Cómo se caracteriza el retiro?
El retiro incluye cápsulas de 1 mg, 2 mg y 5 mg del medicamento afectado. Los fabricantes y distribuidores implicados han sido instruidos para retirar los lotes comprometidos del mercado. Las autoridades sanitarias enfatizan la necesidad de revisar lotes y consultar al profesional de salud.
:quality(75)//media/inside-the-note/pictures/2025/10/31/la_fda-retira-medicamento-para-la-presio-arterial-por-contaminante-cancerigeno_2_0.jpg)
¿Qué deben hacer los pacientes que toman tratamiento para la presión arterial?
Paso uno: no suspendas tu medicamento sin consultar
Detener abruptamente un antihipertensivo puede provocar un aumento de presión arterial, accidentes cerebrovasculares o infarto. La recomendación oficial es: verifica el lote y consulta con tu médico o farmacéutico.
Paso dos: verifica tu lote y reemplázalo si es necesario
Revisa el envase del medicamento, busca el número de lote y la fecha de caducidad que figuran en los comunicados de retirada. Si tu lote aparece en la lista, contacta con el farmacéutico para su sustitución.
Paso tres: habla con tu profesional de salud sobre alternativas
Si tomabas Prazosin Hydrochloride y tu lote está afectado, tu médico puede valorar una alternativa segura para mantener el control de la presión arterial sin comprometer tu salud. La conversación debe incluir tus factores de riesgo cardiovascular, tolerancia a medicamentos y seguimiento.
¿Qué pasa si no estoy seguro del medicamento que tomo?
Si tienes presión arterial elevada y estás bajo tratamiento, consulta con tu médico cuál es el fármaco exacto, su fabricante y si estás entre los afectados por esta retirada. Este tipo de vigilancias fortalecen tu autocuidado y seguridad.
¿Por qué este tipo de incidentes ocurren y cómo se evitan?
Fallas en los controles de fabricación
El proceso de producción de medicamentos es complejo y puede generarse impurezas si no se controlan adecuadamente las materias primas, los reactivos, el almacenamiento o la manipulación. En este caso, la formación de nitrosaminas es un riesgo reconocido que la FDA monitorea.
Regulación, vigilancia y transparencia
La FDA y otros reguladores internacionales desarrollaron el método CPCA para establecer límites seguros en nitrosaminas, lo que ayuda a detectar impurezas antes de que lleguen al paciente. Sin embargo, cuando el sistema falla, la retirada del producto es la medida extrema disponible.
Implicaciones para la confianza del paciente
Cuando un medicamento confiable se ve cuestionado, se genera un daño colateral en la confianza del sistema sanitario. Para los pacientes con hipertensión, ya con una carga diaria de tratamiento, enfrentar una retirada puede aumentar ansiedad y riesgo de incumplimiento. El entendimiento y el acompañamiento médico cobran mayor peso.
La frase “medicamento para presión arterial retirado por impurezas cancerígenas” debe servir como un impulso para que revises tu tratamiento, te comuniques con tu especialista y no tomes la suspensión ligera. Porque cada decisión cuenta cuando hablamos de salud y confianza.
Si tú o un familiar toman antihipertensivos, revisen juntos el lote, hablen hoy con el médico y aseguren que el control de la presión siga siendo firme y confiable. Esta es una nota para hacer consciente el ejercicio de estar bien cuidado.
Mantente informado las 24 horas, los 7 días de la semana. Da click en el enlace y descarga nuestra App!